Der Zelltod als Krankheitsbeschleuniger
Das Immunsystem dient eigentlich dazu, den Körper zu schützen. Gerade bei Organen wie dem Darm, der Lunge oder der Haut ist das Immunsystem stark gefordert. Brunner bezeichnet sie als „Pforten nach außen“, durch die Bakterien oder Viren in den Körper gelangen können. „Manchmal passiert es, dass die Schädigung nicht durch die eigentliche Erkrankung entsteht, sondern durch die dadurch ausgelöste extreme Immunantwort des Körpers“, so der Wissenschaftler. Das kann beispielsweise bei einer viralen Hepatitis der Fall sein, die der Leber weniger Schaden zufügt als die chronischen Entzündungen, die als Folge der körpereigenen Immunabwehr auftreten. Aber auch Asthma, verschiedene allergische Reaktionen oder entzündliche Darmerkrankungen wie Morbus Crohn oder Colitis ulcerosa sind vermutlich auf Überreaktionen des Immunsystems zurückzuführen, die sich auch zu einem späteren Zeitpunkt noch katastrophal auswirken können: So haben etwa Patientinnen und Patienten, die an Colitis ulcerosa leiden, ein erheblich gesteigertes Risiko, an Darmkrebs zu erkranken.
„Im Kern versucht meine Arbeitsgruppe nachzuvollziehen, wie akute und chronische Entzündungsreaktionen zum Zelltod führen und wie dieser wiederum zur Krankheitsentwicklung beiträgt.“
Prof. Dr. Thomas Brunner, Biochemische Pharmakologie
In diesem Zusammenhang nutzt die AG Brunner unter anderem den Ansatz des „Drug Repurposing“, bei welchem existierende Substanzen daraufhin untersucht werden, ob sie für neue Funktionen verwendbar sind. Dazu gehören auch Thiazolide, eine als Medikamente zugelassene Substanzklasse, die eigentlich zur Behandlung von parasitär oder bakteriell verursachten Darminfektionen eingesetzt wird. Von Thiazoliden ist bekannt, dass sie den Zelltod bei kolorektalen Tumoren auslösen können, ohne das normale Gewebe zu schädigen. Der entsprechende Nachweis wurde bereits mittels verschiedener in-vitro-Versuche mit echten Tumoren und gesundem Darmgewebe erbracht.
© Inka Reiter„Der Ansatz des Drug Repurposing hilft uns entscheidend dabei, Unterschiede zwischen normalem und Tumorgewebe zu identifizieren und somit gezielte Anwendungen zu entwickeln.“
Prof. Dr. Thomas Brunner, Biochemische Pharmakologie
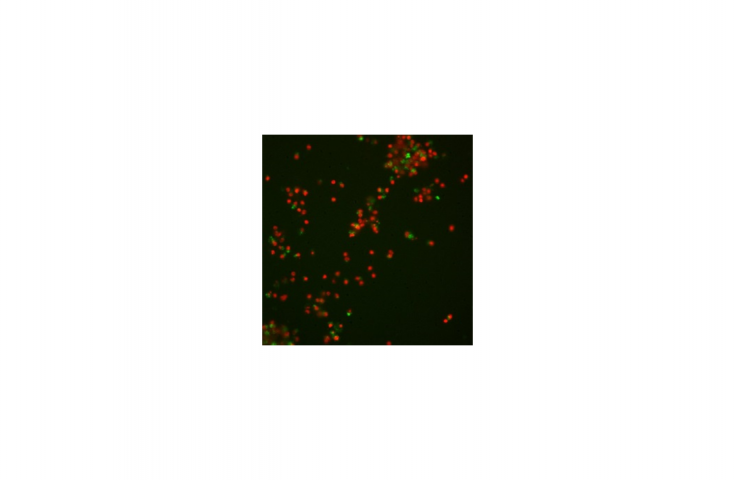
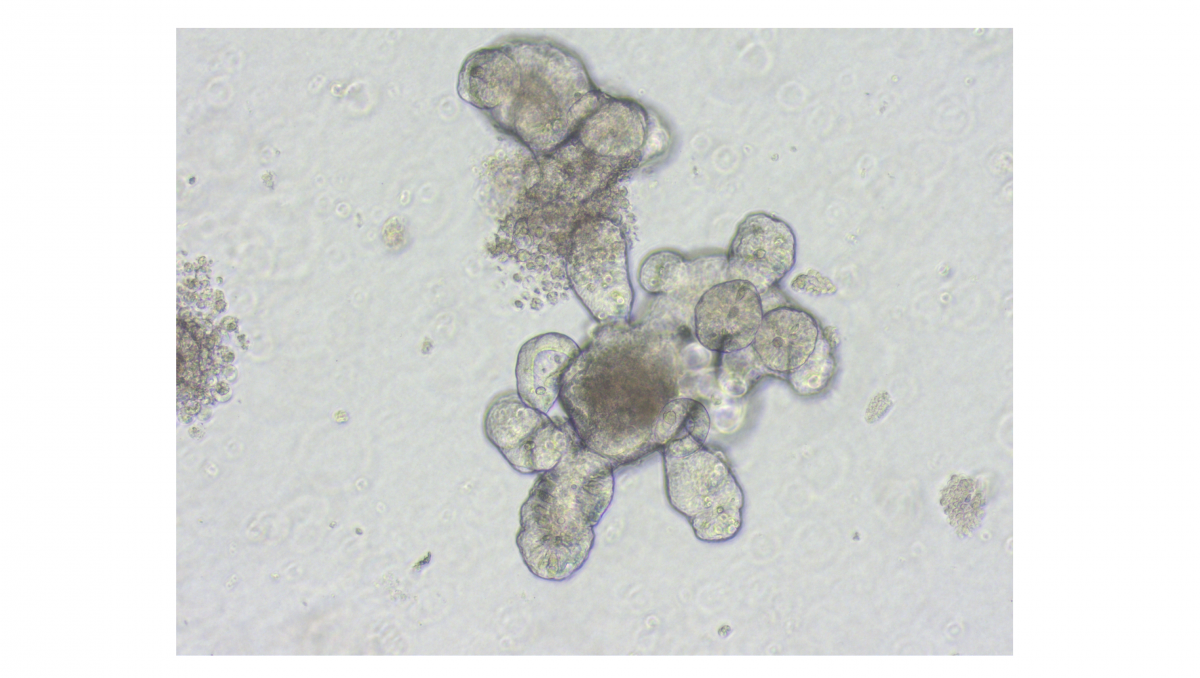
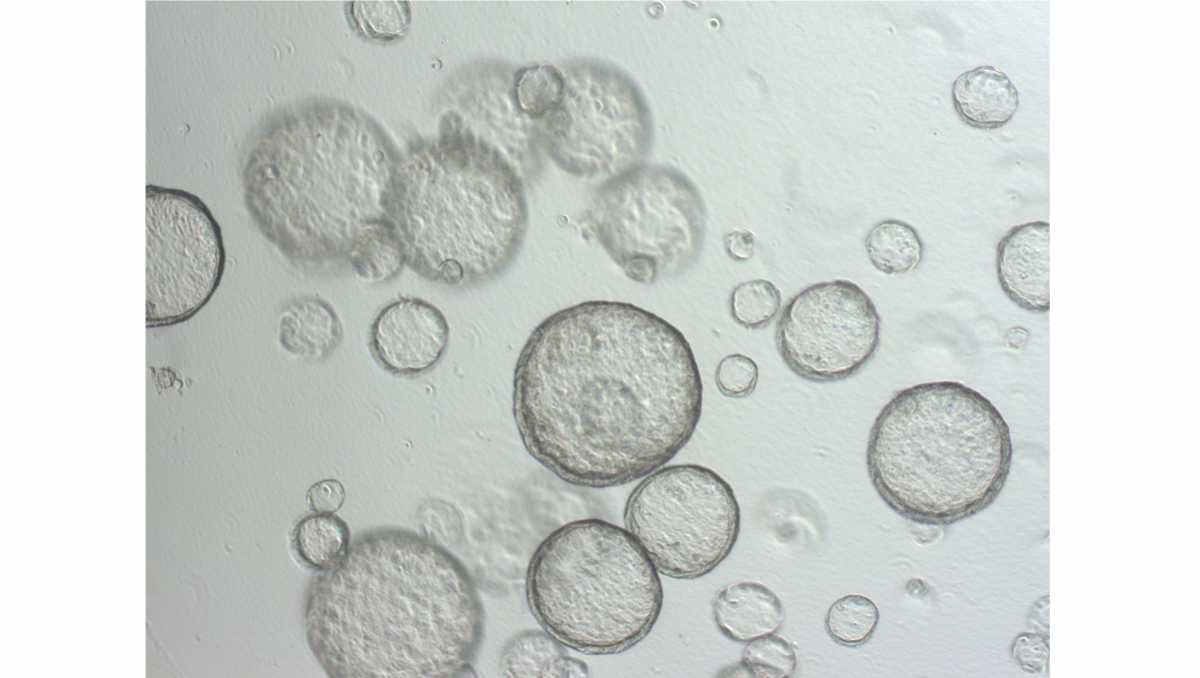
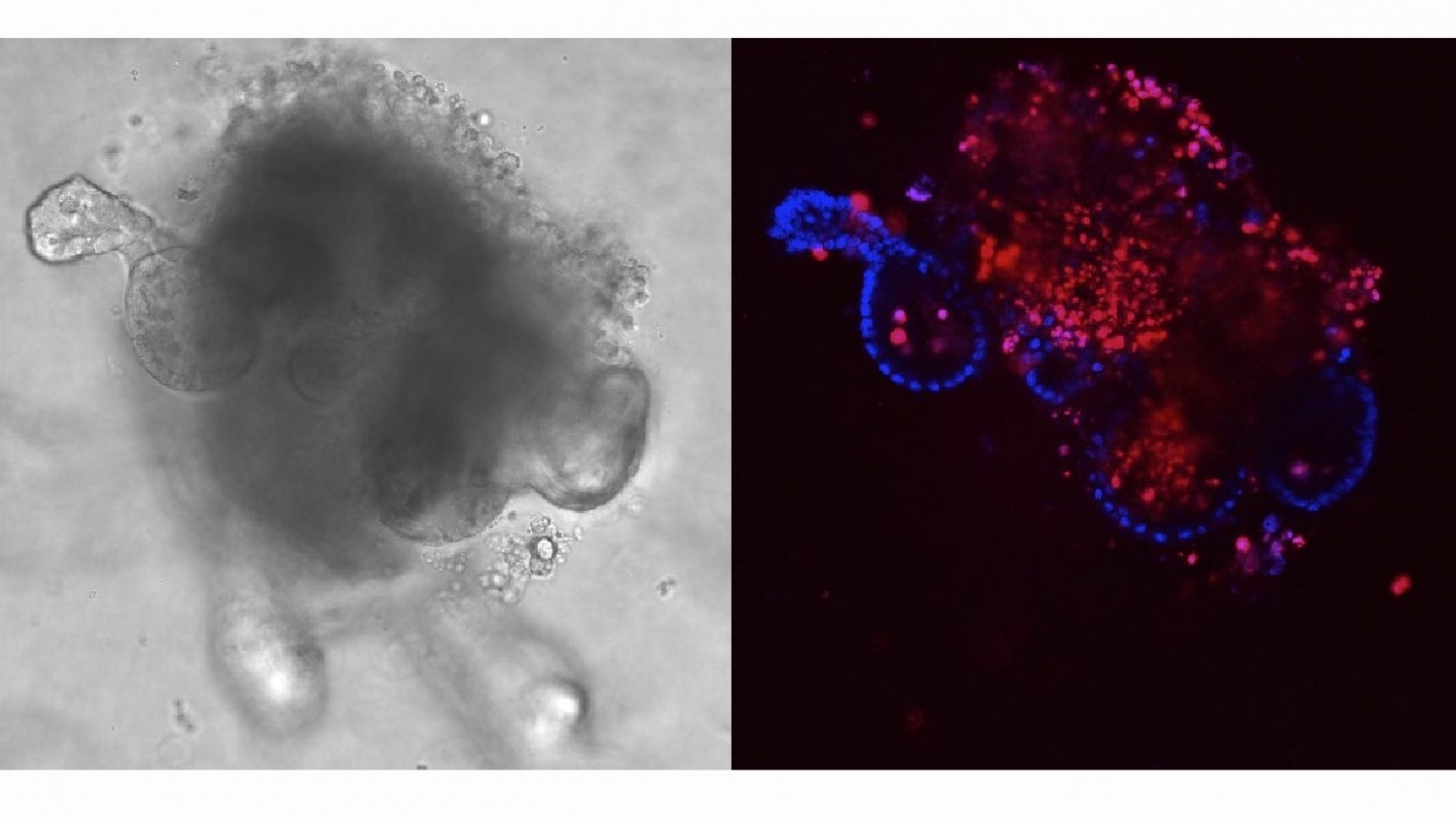
© Thomas BrunnerLinks: Organoid des Dünndarms unter dem Phasenkonstrast-Mikoskop
Rechts: Gleiches Organoide unter dem Fluoreszenz-Mikroskop, in welchem Zellkerne blau angefärbt sind und tote Zellen rot zum Nachweis von Zelltod
Ein weiterer Ansatz wurde unter dem Dach der von der Deutschen Forschungsgemeinschaft (DFG) geförderten Forschungsgruppe FOR 2036 „New insights into Bcl-2 family interactions: from biophysics to function/new relations in the Bcl-2 family“ verfolgt. Die Forschungsgruppe unter Beteiligung der AG Brunner, die im April 2022 das Ende der Förderung erreicht hat, auf deren Grundlage aber bereits weitere internationale Kooperationsprojekte geplant sind, erforschte die Bcl-2-Proteinfamilie, die für die Regulierung von apoptotischem Zelltod verantwortlich ist. Das internationale Konsortium aus deutschen, österreichischen und Schweizer Wissenschaftlerinnen und Wissenschaftlern beschäftigte sich damit, wie die Aktivität von Bcl-2-Proteinen gesteuert werden kann, um Krebszellen abzutöten.
Weiterlesen: Der Zelltod als Indikator für toxische Wirkungen (Kapitel 8 von 10)
Zurück zur Artikelreihe
Dr. Tullia Giersberg
Verwandte Artikel: