Sonderforschung Proteostase: ein Blick (zurück) nach vorn
Wenn wir die Geheimnisse des Lebens entschlüsseln möchten, müssen wir tief in die Zellen unseres Körpers hineinschauen. In jeder Sekunde finden dort geschäftige Prozesse statt: unzählige Proteine entstehen, werden um- und abgebaut, interagieren miteinander und werden innerhalb der Zelle transportiert. Die Gesamtheit dieser Prozesse im Gleichgewicht zu halten, ist essenziell dafür, die Zellen – und damit den Organismus – gesund und am Leben zu halten. Doch wie funktioniert das? Wie werden beispielsweise die Proteine einer Zelle in ihrer Aktivität reguliert? Und wie sind die einzelnen Regulationswege räumlich und zeitlich miteinander vernetzt? Mit diesen Fragen beschäftigt sich das vergleichsweise junge Forschungsfeld der Proteostaseforschung, dessen konzeptionelle Geburtsstunde auf einen Artikel aus dem Jahr 2008 zurückgeht.
Der SFB „Chemische und biologische Prinzipien der zellulären Proteostase“, der 2012 an der Universität Konstanz startete und im Dezember dieses Jahres ausläuft, war das erste große Forschungskonsortium in Deutschland, das sich dem Konzept der Proteostase widmete. Die WissenschaftlerInnen des SFB haben das neu entstandene Forschungsfeld dadurch von Beginn an geprägt und mitgestalten können. Ein entscheidender Standortvorteil der Universität Konstanz damals wie heute: die außergewöhnlich enge interdisziplinäre Zusammenarbeit der Konstanzer BiologInnen und ChemikerInnen.

„An der Universität Konstanz haben wir bereits früh die Chancen erkannt, die sich ergeben, wenn Chemiker und Biologen über ihre Fachgrenzen hinaus zusammenarbeiten. Als das Konzept der Proteostase aufkam, wurde Interdisziplinarität in Konstanz bereits aktiv gelebt. Wir waren also bestens auf die Herausforderungen dieses neuen Forschungsfelds vorbereitet und konnten direkt loslegen.“
Andreas Marx, Professor am Fachbereich Chemie
Andreas Marx ist einer der am SFB maßgeblich beteiligten Forschenden und außerdem Sprecher der Graduiertenschule „Chemische Biologie“ der Universität Konstanz, die von 2007 bis 2019 im Rahmen der Exzellenzinitiative gefördert wurde und eines der bereits bestehenden Fundamente war, auf denen der Konstanzer SFB aufbauen konnte. Auch für Elke Deuerling, Professorin am Fachbereich Biologie und Sprecherin des SFB 969, war der „Konstanzer Teamspirit“, wie sie es nennt, eine entscheidende Grundvoraussetzung, um die komplexen Fragestellungen der Proteostaseforschung auf international wettbewerbsfähigem Niveau anzugehen:
© Inka Reiter„Dass sich die Chemiker und Biologen einer Universität zusammenschließen, um zum Beispiel völlig neue Methoden und chemische Ansätze zu entwickeln, welche bestimmte biologische Prozesse der Proteostase überhaupt erst erforschbar machen, das war damals ganz klar unser Alleinstellungsmerkmal in Deutschland und vielleicht sogar weltweit.“
Elke Deuerling, Professorin am Fachbereich Biologie
Allgegenwärtig und doch in großen Teilen unbekannt
Ein Beispiel für ein solches chemisches Werkzeug sind synthetische Ubiquitin-Ketten, deren gezielte Herstellung Konstanzer ChemikerInnen und BiologInnen um Andreas Marx, Martin Scheffner und Florian Stengel im Rahmen des SFB gelang. „Ubiquitin ist ein kleines Protein, das in unseren Zellen allgegenwärtig ist – das sagt bereits sein Name aus. Es markiert dort durch Bindung andere Proteine, beispielsweise um deren zelluläre Funktion ab- oder umzuschalten“, erklärt Scheffner die allgemeine Bedeutung des Proteins. Sowohl technisch als auch biologisch war die Möglichkeit, auf Wunsch bestimmte Ubiquitin-Verkettungen herzustellen, ein riesiger Fortschritt, den die Forschenden direkt für weiterführende Untersuchungen nutzen konnten. So war es ihnen möglich, bisher unbekannte Interaktionspartner der hergestellten Ubiquitin-Ketten zu identifizieren und zuvor unzugängliche Aspekte der Proteinmodifikation aufzudecken.
Ubiquitine werden in der Zelle jedoch nicht nur untereinander und mit anderen Proteinen verknüpft. Um ihre Funktion bei der Regulation verschiedener Zellvorgänge zu gewährleisten, muss es genauso Mechanismen geben, die Ubiquitine wieder trennen und abspalten. Auch hier ist es dem Team um Michael Kovermann, Karin Hauser, Christine Peter und Erika Isono gelungen, neue Mechanismen der Abspaltung von Ubiquitin von seinen Substraten aufzudecken. „Wir konnten zeigen, dass es membrangebundene Enzyme in der Pflanzenzelle gibt, die Ubiquitin abspalten und so den Transport von anderen Membranproteinen regulieren – zum Beispiel, um auf Umweltreize zu reagieren. Zusätzlich konnten wir durch unsere Analysen ein Modell entwickeln, wie die Aktivierung dieser Enzyme gesteuert wird“, fasst Isono vom Fachbereich Biologie der Universität Konstanz die Ergebnisse einer der Studien aus dem SFB zusammen.
Den Schluss nicht vor dem Anfang denken
Die Verknüpfung mit und die Abspaltung von Ubiquitinen ist zwar eine der häufigsten Protein-Modifikationen, es gibt jedoch zahlreiche weitere Modifikationen und Faktoren, die die Aktivität von Proteinen in der Zelle steuern und umschalten können. Gerät einer dieser Regulationsmechanismen aus dem Gleichgewicht oder funktioniert fehlerhaft, kann dies katastrophale Folgen für die Zelle und den gesamten Organismus haben. So sind zahlreiche Krankheiten, beispielsweise Krebs oder neurodegenerative Erkrankungen, auf Fehlregulationen des zellulären Proteinhaushalts zurückzuführen. Die Forschung der Konstanzer WissenschaftlerInnen wird also dabei helfen, die Entstehung solcher Krankheiten besser nachzuvollziehen und mögliche Therapien zu entwickeln.
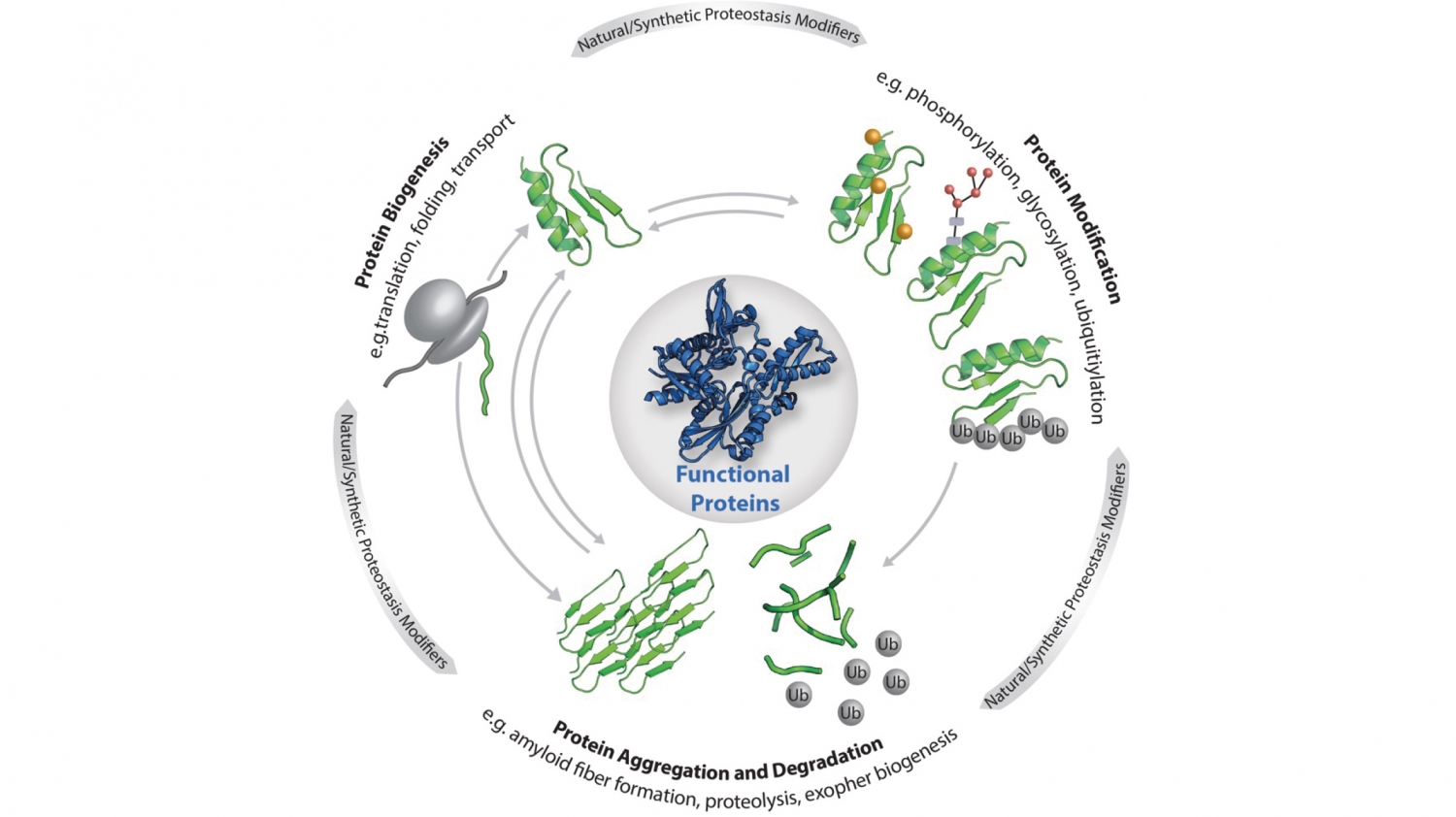
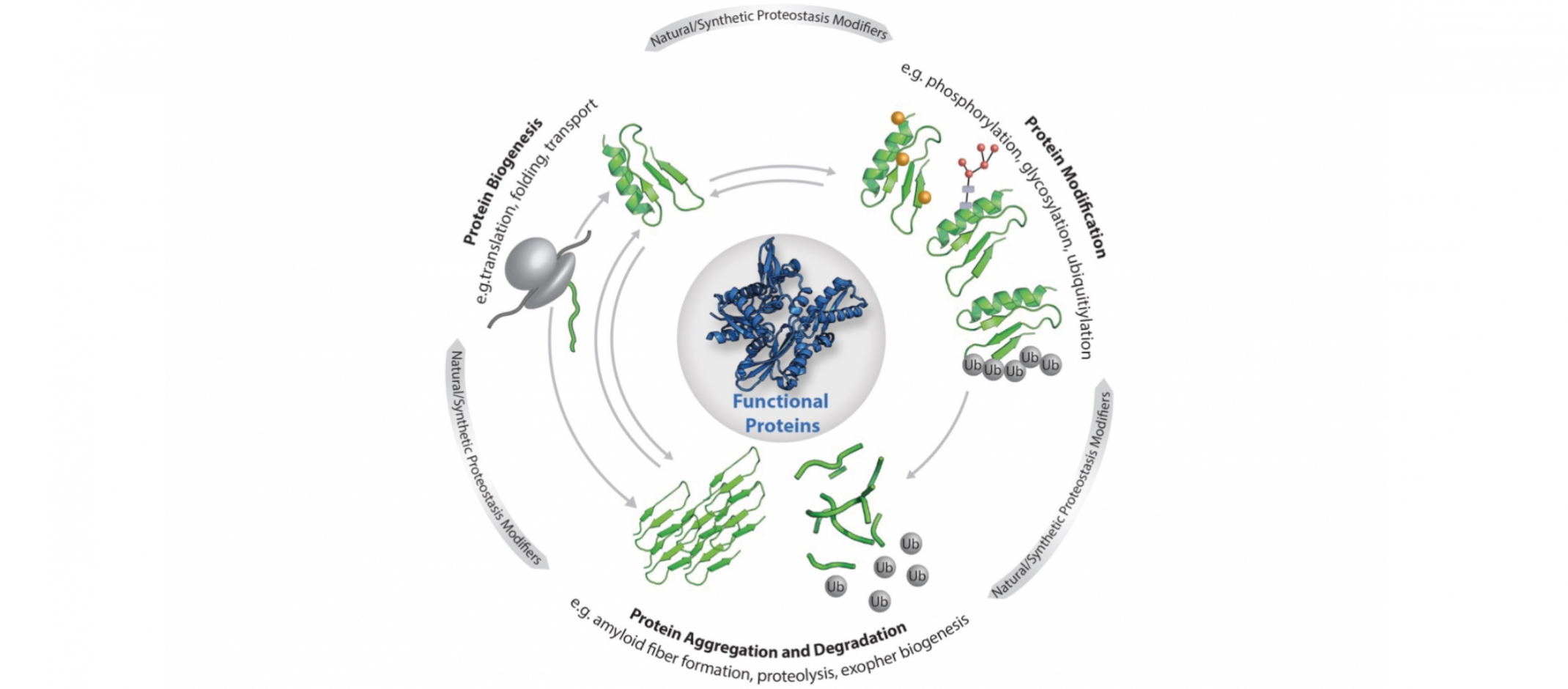
© Elke DeuerlingDie zelluläre Proteostase: Die Funktionalität der einzelnen Proteine, aus denen das Proteom besteht, wird durch die dargestellten zentralen Prozesse (Biogenese, Modifikation, Abbau und Aggregation) reguliert. Die Proteostase wird zudem beeinflusst von Stress, Alterung, Metaboliten sowie maßgeschneiderten Liganden, kleinen Molekülen und künstlichen Proteinmodifikationen.
Die Forschung der Konstanzer WissenschaftlerInnen wird also dabei helfen, die Entstehung solcher Krankheiten besser nachzuvollziehen und mögliche Therapien zu entwickeln. „Nur wenn wir verstehen, wie die Zelle an sich funktioniert und wie ihre Proteine aktiviert und reguliert werden, können Ansätze entwickelt werden, um krankheitsverursachenden Ungleichgewichten in der Proteostase entgegenzutreten. Darum machen wir im SFB vorrangig Grundlagenforschung – weil wir ursächliche Vorgänge verstehen wollen. Die Anwendung ist natürlich auch ein Ziel und kann im nächsten Schritt gedacht werden“, führt Deuerling aus.
Das Kontrollzentrum unserer Proteinfabriken
Deuerlings Arbeitsgruppe hat im Rahmen des SFBs ebenfalls bahnbrechende Entdeckungen im Bereich der Proteostaseforschung machen können. Zusammen mit Martin Gamerdinger, Florian Stengel und anderen KollegInnen hat sie beispielsweise herausgefunden, dass es einen Proteinkomplex gibt, der an den Ribosomen – den „Proteinfabriken“ unserer Zellen – die Funktion eines Kontrollzentrums erfüllt: der „nascent polypeptide-associated complex“, kurz NAC.
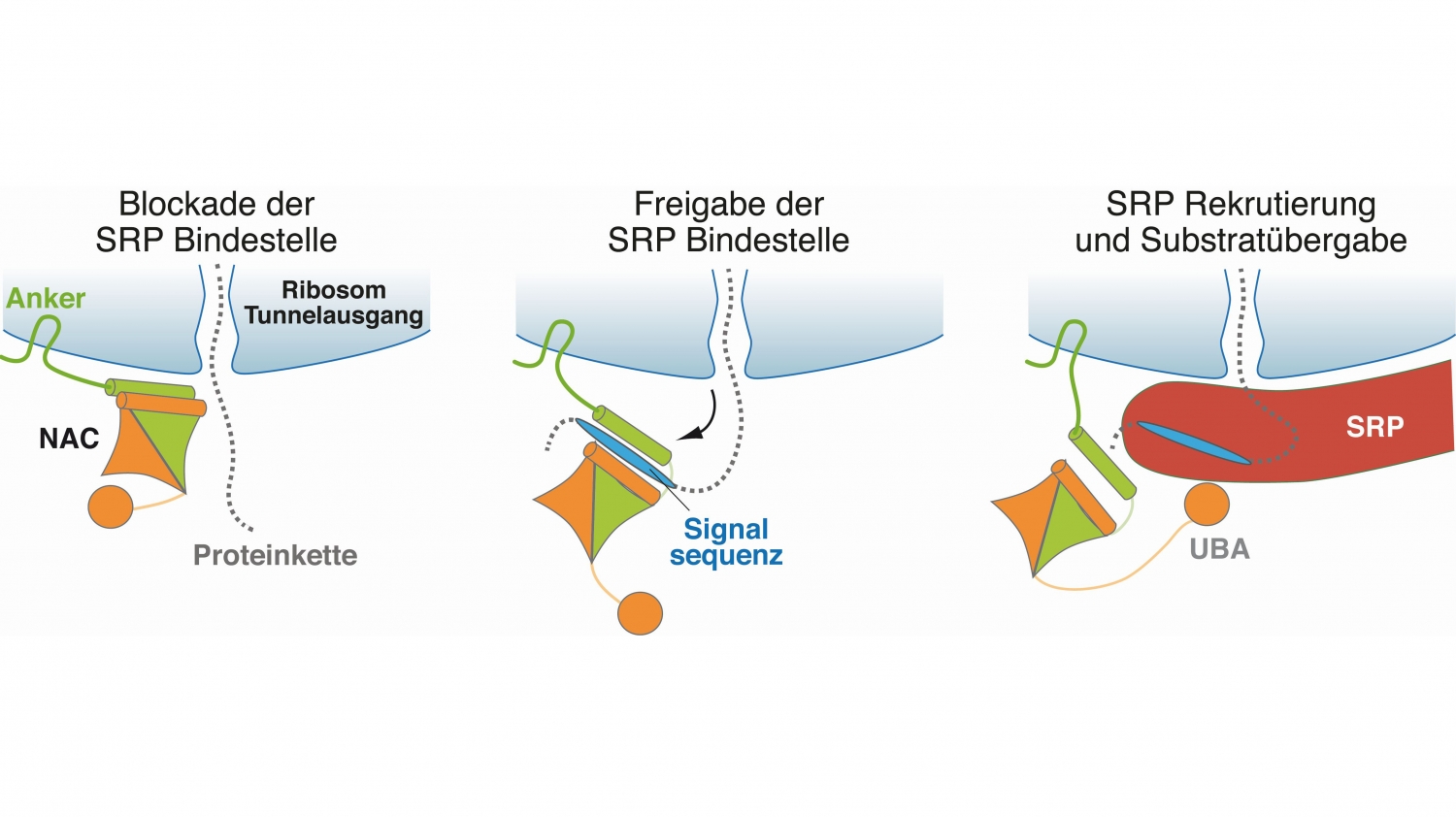
© Martin Gamerdinger, Universität KonstanzNAC reguliert den Transport von Proteinen innerhalb der Zelle. Die Abbildung zeigt den molekularen Mechanismus hinter dieser Funktion.
„Obwohl NAC schon vor etwa 30 Jahren als Proteinkomplex entdeckt wurde, war seine Funktion bis vor kurzem praktisch unbekannt. Über ausgeklügelte Experimente konnten wir diese im Rahmen des SFB bis hin zum zugrundeliegenden molekularen Mechanismus entschlüsseln.“
Elke Deuerling
In zwei hochrangigen Publikationen zeigten die Forschenden, dass NAC eine zentrale und lebenswichtige Kontrollfunktionen übernimmt, indem es sowohl bei der Sortierung neuentstehender Proteine als auch bei deren Modifizierung durch Methionin-Abspaltung eine wichtige Rolle spielt.
Was gewachsen ist, auch pflegen
Tatsächlich konnte der SFB in allen Bereichen, welche die beteiligten BiologInnen und ChemikerInnen in ihren Projekten in Angriff genommen haben, substantielle Fortschritte erzielen und Erkenntnisse gewinnen – sei es zur Herstellung von Proteinen, deren Modifizierung durch chemische Gruppen oder zu Proteinaggregation und -abbau. Die zuvor genannten Beispiele geben hier nur einen kleinen Einblick. „Ich denke, dass unser SFB einen wichtigen Beitrag in der Proteostaseforschung erbracht hat. Wir haben essentielle Erkenntnisse zur Proteostase gewonnen, aber auch tolle Ideen für zukünftige Forschungsprojekte entwickelt“, resümiert Deuerling. Das notwendige Fundament für die Zukunft wurde also durch den SFB gefestigt.
„Der Teamgeist, das Know-how und die Infrastruktur, wie unsere Core Facilities mit hochspezialisiertem Equipment, waren vor 2012 schon da. Für den SFB und unsere wissenschaftlichen Fragestellungen war es jedoch unerlässlich, das, was bereits gewachsen war – diese großartige Basis –, stetig zu erneuern, zu verbessern und zu erweitern. Das gilt auch für unser Team. In den zurückliegenden zwölf Jahren ist es uns gelungen, hervorragende NachwuchswissenschaftlerInnen für die Universität Konstanz zu begeistern und zu rekrutieren, die den SFB und die hiesige Forschung immens bereichern.“
Elke Deuerling
Den Blickwinkel erweitern
Wenn der SFB im Dezember 2023 nach der längstmöglichen Förderdauer ausläuft, gilt es, den Blick nach vorn zu richten und neue Perspektiven einzunehmen. Mit dem SFB haben die Konstanzer ChemikerInnen und BiologInnen das Wissen, die Methoden und die Strukturen geschaffen und erweitert, auf denen sie nun für zukünftige Großprojekte aufbauen können. Das klare Ziel: die gewachsenen und gefestigten Synergien nutzen, um die Konstanzer Proteostaseforschung auf die nächste Stufe zu heben. Dabei stehen die Forschenden bereits mit ihren neuen Ideen in den Startlöchern. „Wir würden beispielsweise in Zukunft gerne einen stärkeren Fokus darauf setzen, wie Zellen ihre Proteostase in Reaktion auf mechanischen oder chemischen Stress regulieren“, gibt Isono ein Beispiel, das direkt auf bestehendem Know-how aufbaut.
Perspektivisch geht es den Forschenden jedoch auch darum, den Blickwinkel über die Ebene der Proteine hinaus zu erweitern, um das große Ganze zu betrachten. Denn auch wenn die Regulierung des Proteoms zweifelsohne einer der fundamentalsten und lebenswichtigsten Vorgänge auf Zellebene ist, so ist dieser nicht frei von Einflüssen durch andere zelluläre Moleküle und Netzwerke, wie das der Nukleinsäuren. Vereinfachend ließe sich also sagen, dass im Rahmen des SFB bisher vorrangig die zweidimensionale Vernetzung von Prozessen auf Proteinebene untersucht wurde.
„Ein nächster Schritt muss deshalb sein, in die dritte Dimension zu wechseln und zu schauen, wie die Ebene der Proteine mit anderen fundamentalen Ebenen, wie der der Nukleinsäuren, vernetzt ist und wie die biochemische Kommunikation in diesem dreidimensionalen Netzwerk abläuft. Das ist unsere nächste große Aufgabe, auf die wir uns durch unsere Arbeit im SFB und die wunderbaren Ansätze, die wir darin entwickeln konnten, ein weiteres Mal sehr gut vorbereitet fühlen“, schließt Deuerling.