Der Zelltod als Therapieansatz
Für die Bildung des Biopolymers Poly-ADP-Ribose-Polymerasen (PARP; siehe „Zellreparatur als Alternative zum Zelltod“) ist ein Substrat nötig, das sogenannte Nicotinamid-Adenin-Dinukleotid oder kurz NAD, das an verschiedenen Vorgängen in der Zelle beteiligt ist. Treten zu viele DNA-Strangbrüche in einer Zelle auf, kann es passieren, dass die NAD-Spiegel zu stark absinken. Tritt dieser Fall ein, hat das auch Auswirkungen auf die zellulären Spiegel von Adenosintriphosphat (ATP), welches als universeller Energieträger der Zelle dient. Ein akuter Abfall der ATP-Spiegel in der Zelle kann somit zum Zelltod führen. „Es handelt sich um ein Kontinuum“, erläutert der Toxikologe apl. Prof. Dr. Aswin Mangerich: „Sind nur wenige DNA-Schäden aufgetreten, unterstützt PARP die Zellreparatur. Je mehr Schädigungen stattgefunden haben, desto eher führt der für die Bildung von PARP zugrundeliegende Mechanismus jedoch dazu, dass die Zelle abstirbt. Über solche und verwandte Vorgänge kann eine Hemmung der PARP-Aktivität in der Krebstherapie ausgenutzt werden.”
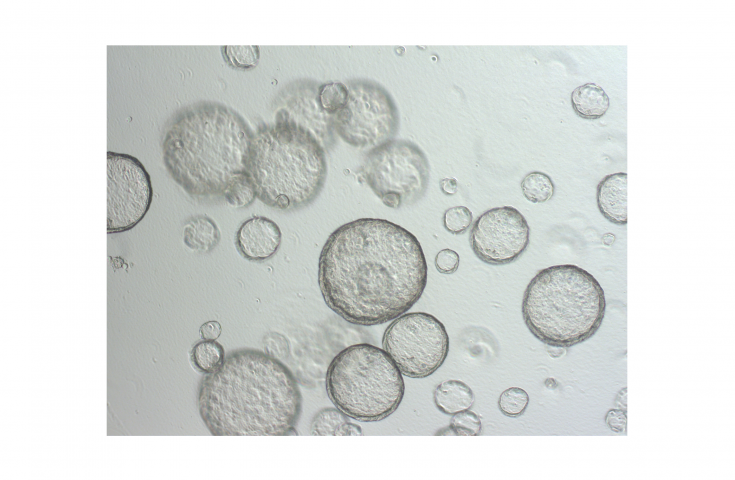
© Marina EngbrechtFluoreszenzmikroskopische Aufnahmen von Zellkernen einer menschlichen Krebszelllinie vor (oben) und nach DNA Schädigung durch Wasserstoffperoxid (unten). Links: Aufnahmen des DNA Reparaturproteins PARP1 (grün), welches eine räumliche Umverteilung im Zellkern nach DNA Schädigung zeigt. Rechts: Gezeigt ist das Syntheseprodukts der PARP1, das Biopolymer Poly(ADP-Ribose) (lila), welches durch aktivierte PARP1 Enzyme nach DNA Schädigung in den Zellkernen gebildet wird und an DNA Reparaturvorgängen beteiligt ist.
Viele klassische Chemotherapeutika wirken DNA-schädigend. Tumore regulieren daher bestimmte DNA-Reparaturwege hoch, die diesen Chemotherapeutika entgegenwirken, sodass das eingesetzte Chemotherapeutikum nicht mehr so gut wirkt. In diesem Fall können sogenannte PARP-Inhibitoren eingesetzt werden, die den Reparaturmechanismus der Zelle lähmen. In der Folge werden die Zellen wieder empfänglicher für klassische Chemotherapeutika, Resistenzen können überwunden und niedrigere Dosen eingesetzt werden. „Andererseits gibt es bestimmte Tumore, die bereits Defekte bei der DNA-Reparatur aufweisen, die ihre Entstehung und ihr Wachstum begünstigen“, so Mangerich. „Bei diesen Zellen kann der Zelltod durch alleinige Gabe von PARP-Inhibitoren herbeigeführt werden.“ Diese werden aktuell bereits in der personalisierten Medizin eingesetzt, zum Beispiel zur Therapie von bestimmten Formen familiären Brustkrebs, Eierstockkrebs und manchen Prostatakarzinomen, bei denen Mutationen in den BRCA-Genen („breast-cancer-associated genes“) vorliegen. Mangerich und sein Team erforschen unter Einsatz von Zellkulturen, menschlichen Blutzellen sowie des Modellsystems C. elegans (Fadenwurm) die Rolle der PARP Proteine in zellbiologischen Vorgängen und wie PARP-Inhibitoren auf molekularer Ebene wirken.
Umgekehrt interessieren sich die Wissenschaftlerinnen und Wissenschaftler auch dafür, wie sich der Zelltod bei nicht-entarteten Zellen durch sogenannte „NAD-Booster“ unter Umständen verhindern lässt. Als ein solcher Booster kann beispielsweise Vitamin B3 (Nicotinsäure und damit verwandte Substanzen) dazu beitragen, die abgesunkenen NAD-Spiegel – etwas, das vor allem auch bei älteren Personen auftritt – wieder anzuheben und so ein gesundes Überleben der Zelle zu ermöglichen.

„Wir sprechen hier allerdings nicht von einer wunderwirkenden Verjüngungskur, die uns allen ewiges Leben schenkt.“
apl. Prof. Dr. Aswin Mangerich
„So einfach funktioniert das leider nicht. Es geht vielmehr darum, herauszufinden, ob NAD-Booster therapeutisch bei bestimmten Entzündungs- und Zelltodvorgängen von Nutzen sein können.“
In diesem Zusammenhang arbeitet die Arbeitsgruppe um Prof. Dr. Alexander Bürkle und Aswin Mangerich seit Jahren mit dem Institut der Pharmakologie und Toxikologie der Bundeswehr in München zusammen, das sich als Forschungsinstitut ausschließlich mit den Auswirkungen von chemischen Kampfstoffen beschäftigt, um neue Therapien und diagnostische Verfahren zu entwickeln. „Konkret beschäftigten wir uns mit den Auswirkungen von Senfgas und davon abgeleiteten Stoffen, die interessanterweise als Chemotherapeutika in der Krebstherapie zum Einsatz kommen“, so Mangerich. Senfgas wirkt toxisch, indem es DNA-Schäden verursacht und DNA kreuzvernetzt. Kurzfristig führt das zu charakteristischen Entzündungen der Haut, Lunge und Augen. Langfristig haben Personen, die Senfgas ausgesetzt waren, über 20 bis 30 Jahre hinweg ein erhöhtes Krebsrisiko.
Aus dem gemeinsamen wissenschaftlichen Projekt ist bereits eine Methode entwickelt worden, mit der Senfgas-DNA-Addukte massenspektrometrisch nachgewiesen werden können – was nicht nur medizinisch wichtig und sinnvoll ist, sondern insbesondere bei Untersuchungsproben aus Krisengebieten auch unter völkerrechtlichen Aspekten bedeutsam werden kann. Ein weiteres, eher therapeutisch ausgerichtetes Projekt beschäftigt sich damit, wie NAD-Booster eingesetzt werden könnten, um Entzündungs- und Zelltodvorgänge zu untersuchen, die an der Pathologie bzw. Pathogenese von Senfgas-Toxizität beteiligt sind.
Weiterlesen: Der Zelltod als Krankheitsbeschleuniger (Kapitel 7 von 10)
Zurück zur Artikelreihe
Tullia Giersberg
Verwandte Artikel: